【初中化学】人教版九年级上册 第五单元 化学方程式
 2021-10-05
2021-10-05 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
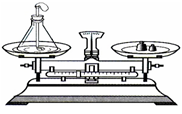
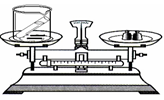
第五单元 化学方程式 课题1 质量守恒定律 1、测定红磷燃烧前后的质量实验 【现象】红磷燃烧,产生大量白烟;气球先胀大后缩小 【实验原理】4P+5O2 点燃 2P2O5 【结果】天平平衡 【结论】参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和 【注意事项】 ①锥形瓶底部铺一层细沙的作用:防止锥形瓶底部局部温度过高而炸裂 ②用红热的玻璃管接触红磷的作用:引燃红磷 ③气球的作用:防止瓶内气体受热膨胀而冲开橡胶塞 2、测定铁钉跟硫酸铜溶液反应前后的质量实验 【现象】铁钉表面有红色物质生成,溶液由蓝色变成浅绿色 【实验原理】Fe + CuSO4 = FeSO4 + Cu 【结果】天平平衡 【结论】参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和 【注意事项】 先用砂纸将铁钉打磨干净的原因:除去铁钉表面的铁锈 3、测定盐酸与碳酸钠粉末反应前后的质量实验 【现象】固体粉末逐渐溶解,有气泡产生 【实验原理】Na2CO3+2HCl=2NaCl+H2O+CO2↑ 【结果】天平不平衡 【分析】该反应是符合质量守恒定律。 天平指针偏右(变轻),原因是:生成的二氧化碳气体逸出到空气中。 4、测定镁条燃烧反应前后的质量实验 【现象】发出耀眼的白光,放出热量,生成白色固体粉末 【实验原理】2Mg+O2 点燃 2MgO 【结果】天平不平衡 【分析】该反应是符合质量守恒定律。 天平指针偏左(变重),原因是:增加了氧元素的质量(或增加了参与反应的氧气质量)。 【小结】有气体参与或者有气体生成来证明质量守恒定律,则反应一定要在密闭装置中进行。 一、质量守恒定律 【概念】参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。 【注意事项】 ①只有化学变化才遵守质量守恒定律,物理变化不能用质量守恒定律解释; ②没有参加反应(或剩余)的物质的质量不能算在内。 二、质量守恒定律的微观解释(原子的三不变) 在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。 五个不变 1、 原子的种类 2、原子的数目 3、原子的质量 5、元素的质量 两个一定改变 1、物质种类 2、分子的种类 课题2 化学方程式 【概念】用化学式表示化学反应的式子 【含义】以C+O2 点燃 CO2为例。【C-12;O-16】 质:⑴表示碳和氧气在点燃条件下反应生成二氧化碳。 量:⑵表示每12份质量的碳与32份质量的氧气完全反应,生成44份质量的二氧化碳。 粒子:⑶表示反应物中碳原子、氧分子和生成物中二氧化碳分子的个数比为 1:1:1 【书写步骤】 ①写:根据事实写出反应物和生成物的化学式,用短线相连、并注明反应条件 ②配:配平化学方程式,配平后将短线改成等号“=” ③标:标出生成物状态“↑”或“↓” 一、【配平方法】用最小公倍数法 ①找原子数目最多的 如: P+O2 点燃 P2O5 ②看分布(两边各出现一处) 2 5 ③计算出最小公倍数 10 ④配上化计量数 P+5O2 点燃 2P2O5 ⑤再配平其他原子 4P+5O2 点燃 2P2O5 ⑥短线变成等号 4P+5O2 点燃 2P2O5 ②看分布(同边都出现) 1 3 ③计算出最小公倍数 3 ④配上化计量数 3CO + Fe2O3 高温 Fe + CO2 ⑤再配平其他原子 3CO + Fe2O3 高温 2Fe + 3CO2 ⑥短线变成等号 3CO+Fe2O3 高温 2Fe + 3CO2 --------------------------------------------------- 有原子团的配平 如:Al+H2SO4—Al2(SO4)3+H2 ①先配原子团 1 3 二、“↑”“↓”符号的使用 ①只有生成物中有气体时需加“↑”。如:2Al+3H2SO4=Al2(SO4)3+3H2↑ 注:有气体参与反应不需加“↑”。如:CH4+2O2 点燃 CO2+2H2O ②只有生成物中有难溶的固体物质时需加“↓”。如:CO2+Ca(OH)2=CaCO3↓+H2O 课题3 化学方程式计算 【计算类型】 1、知一物,求其它物; 2、涉及体积; 3、利用质量守恒定律; 4、含杂质计算 含杂质计算公式 纯净物的质量分数(简称“纯度”)是指纯净物占混合物的质量分数。 【公式】 混合物=纯净物÷纯度 【例题】200g含碳酸钙80%的石灰石与足量的稀盐酸反应,求生成二氧化碳的质量是多少? 【C-12;O-16;Ca-40】 【分析】200g→石灰石(混) 解:碳酸钙的质量为:200g×80%=160g 【分析】100g→石灰石(混) 4、4g→二氧化碳(纯量) 求:纯度 解:设石灰石中碳酸钙的质量是x 化学方程式小结 1. 质量守恒定律 (1)概念(反应物和生成物前后质量不变)。 (2)原因(三不变:原子种类、数目、质量反应前后不变)。 (3)化学方程式有关计算。 说明: 质量守恒定律只适用于化学变化,不适用于物理变化。 不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中。 要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。 2. 基本反应类型 化合反应:由两种或两种以上物质生成另一种物质的反应。 分解反应:由一种反应物生成两种或两种以上其他物质的反应。 置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版