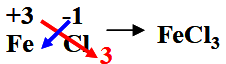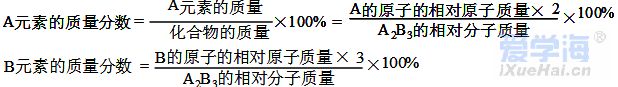【初中化学】人教版九年级上册 第四单元 自然界的水
 2021-10-05
2021-10-05 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
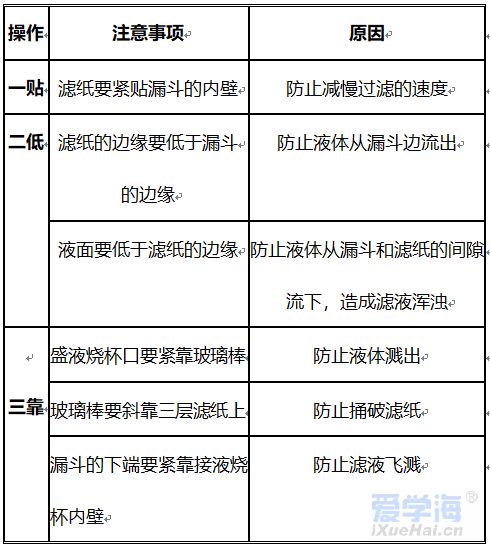
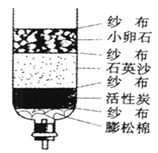
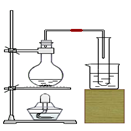
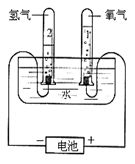
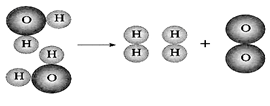
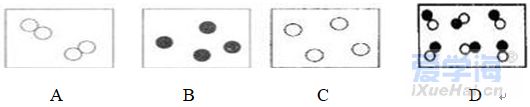
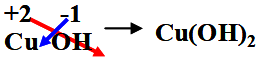
第四单元自然界的水 课题1 爱护水资源 一、水资源 1、最常见的液体是水。 2、地球上的水储量是丰富的,但可供利用的淡水资源是有限的。 3、我国水资源的现状是分布不均匀,人均水量很少。属轻度缺水的国家。 二、爱护水资源 【措施】一方面要节约用水;另一方面要防治水体污染。 【节约用水】例如:①用洗衣水冲马桶;②用淘米水淋花。 水污染的来源:工业污染、农业污染、生活污染 例如:工业“三废”的任意排放 农业中化肥、农药的不合理使用 生活污水的任意排放 【防治】 ①加强对水质的监测 ②工业废水经处理符合标准后才排放。 ③农业上提倡使用农家肥,合理施用化肥和农药 ④生活上污水集中处理达标后才排放。 【注】不使用含磷洗衣粉 课题 2 水的净化 自然界的水都不是纯水,因含有许多不溶性杂质和可溶性杂质。 净水方法程度由低到高排列是:沉淀→过滤→吸附→蒸馏。 明矾的作用:溶于水后生成的胶状物吸附水中的悬浮物,使杂质沉降。 活性炭的作用:吸附水中可溶性杂质,除去颜色、异味。 漂白粉的作用:杀菌、消毒。(属于化学变化) 一、过滤:适用于固体与液体的分离 【仪器】铁架台、玻璃棒、漏斗、烧杯 【操作】(一贴二低三靠) 玻璃棒的作用:引流 可用脱脂棉代替滤纸,饮料瓶代替漏斗。 过滤后滤液仍浑浊的原因: ①液面高于滤纸边缘; ②滤纸破损; ③仪器不干净等。 【改进】应检查装置,更换滤纸或过滤器后再重新进行过滤 二、吸附 常用的吸附剂是活性炭,利用活性炭具有吸附性(属于物理变化) 家庭自制简易净水器(右图) 小卵石和石英沙的作用:过滤; 活性炭和膨松棉的作用:吸附。 三、硬水与软水 硬水:含有较多可溶性钙、镁化合物的水。 区分方法:用肥皂水检验。有较多泡沫产生的水是软水;有较少泡沫产生的水是硬水。 硬水的危害: ①长期饮用硬水有害人体健康; ②硬水洗衣浪费肥皂且洗不净; ③锅炉烧硬水导致锅炉爆炸。 暖壶结水垢(主要成分是CaCO3)可用食醋除去。 硬水的软化方法:煮沸和蒸馏。 四、蒸馏 蒸馏瓶中的沸石或碎瓷片的作用:防止加热时出现暴沸。 烧杯中水的作用是:冷却 注:蒸馏后的水是纯净水 课题3 水的组成 探究水的组成实验 在实验中加入少量氢氧化钠的作用是:增强水的导电性 【现象】 两电极都有气泡产生,正极与负极产生气体的体积比为1:2 记忆方法:正氧负氢,氢二氧一 【检验气体】正极产生的气体可以使带火星的木条复燃,是氧气;负极产生的气体能够燃烧,火焰呈淡蓝色,是氢气。 【化学方程式】2H2O通电2H2↑+O2↑ 正极与负极产生气体的体积比为少于1:2的原因是: ①相同条件下,氧气在水中的溶解度比氢气大。 ②产生的氧气与电极发生了氧化反应,消耗了氧气。 【示意图结论】 ① 水在通电的条件下分解生成氢气和氧气 ②反应前后元素种类不变 ③在化学反应中,分子可分,原子不可分。 物质分类 化合物:由不同种元素组成的纯净物。 氧化物:由两种元素组成的化合物,其中一种元素是氧元素 单质与化合物示意图:图示中,表示单质的是 ABC;表示化合物的是 D。 课题4 化学式与化合价 一、化学式 【概念】 用元素符号和数字表示物质组成的式子。例如:H2O 【意义】 以水(H2O)为例 宏观:表示水这种物质; 表示水由氢元素和氧元素组成 微观:表示1个水分子; 表示1个水分子由2个氢原子和1个氧原子构成 二、单质的化学式书写 由原子构成的单质 1、金属单质 如:Cu Fe Mg 2、非金属固态单质 如:C P S 3、稀有气体单质 如: He Ne 直接用元素符号表示化学式 由分子构成的单质 用元素符号和右下角所含原子的个数表示 (常在元素符号的右下角加“2”表示)如:H2 O2 N2 Cl2 【原则】在化合物中各元素正负化合价的代数和为零。(是检查化学式是否正确的依据) 【步骤】正价在左,负价在右;把化简后的数字交叉写出 氯化铁: 硫酸亚铁: 氢氧化铜: 四、化学式的读法(一般“从尾读到头”) ①由两种元素组成的化合物,读作“某化某”,例如: FeCl3读作氯化铁; 氧元素与变价元素结合时,则读“几某化几某”,例如:P2O5读作五氧化二磷。 ②含有酸根的原子团(NO3、CO3 、SO4)化合物读作“某酸某”,例如:AgNO3读作硝酸银;Na2CO3读作碳酸钠; Na2SO4读作硫酸钠。 ③含有原子团(OH)的化合物读作“氢氧化某”。Ca(OH)2读作氢氧化钙。 ④H与酸根结合读作“某酸”。例如:HCl读作盐酸;H2SO4读作硫酸;HNO3读作硝酸;H2CO3读作碳酸。 注:+2价的铁读作亚铁,如FeCl2 读作氯化亚铁 ;FeSO4读作硫酸亚铁。 五、化合价 1、有正价和负价,金属元素通常显正价,非金属元素通常显负价。 2、在化合物中各元素正负化合价的代数和为零。 3、在单质分子里,元素的化合价为零 4、常见元素的化合价口诀: 钾、钠、银、氢+1价; 钙、镁、钡、锌、兼亚铁、铜+2价; 铝、铁+3价; 氯显负价为-1价;氧-2价。 5、原子团的化合价口诀 根的名称 根的符号 常见化合价 同种元素的化合价数与离子的电荷数相等 例如:镁元素的化合价 上方写+2 下方写Mg; 镁离子Mg2+ 【离子符号】 氧离子O2-、氯离子Cl-、氢离子H+ 钾离子K+、钠离子Na+、银离子Ag+ 钙离子Ca2+、镁离子Mg2+、钡离子Ba2+ 锌离子Zn2+、铜离子Cu2+、铝离子Al3+ 铁离子Fe3+、亚铁离子Fe2+、铵根离子NH4+ 氢氧根离子OH-、硝酸根离子NO3- 硫酸根离子SO42-、碳酸根离子CO32- 【常见物质的化学式】 氧化钙CaO、氧化镁MgO、氧化铜CuO 氧化铝Al2O3、氧化铁Fe2O3、四氧化三铁Fe3O4 五氧化二磷P2O5、二氧化锰MnO2 氯化钾KCl、氯化钠NaCl、氯化钙CaCl2 氯化镁MgCl2、氯化钡BaCl2、氯化铝AlCl3 氯化铁FeCl3、氯化亚铁FeCl2、氢氧化钾KOH 氢氧化钠NaOH、氢氧化钙Ca(OH)2 氢氧化钡Ba(OH)2、氢氧化铜Cu(OH)2 氢氧化镁Mg(OH)2、氢氧化铁Fe(OH)3 硝酸钾KNO3、硝酸银AgNO3、硝酸钡Ba(NO3)2 硝酸铜Cu(NO3)2、硝酸铁Fe(NO3)3 硝酸亚铁Fe(NO3)2、碳酸钠Na2CO3 碳酸钙CaCO3、碳酸钡BaCO3 硫酸钠Na2SO4、硫酸镁MgSO4 硫酸钡BaSO4、硫酸锌ZnSO4、硫酸铜CuSO4 硫酸铝Al2(SO4)3、硫酸铁Fe2(SO4)3 硫酸亚铁FeSO4、碳酸铵(NH4)2CO3 硫酸铵(NH4)2SO4、硝酸铵NH4NO3 盐酸HCl、硝酸HNO3、碳酸H2CO3、硫酸H2SO4 【注】:水H2O、过氧化氢H2O2、高锰酸钾KMnO4、锰酸钾K2MnO4、氯酸钾KClO3 六、计算SO2中S的化合价依据:正负化合价的代数和为零。 公式:代数和 = 各种元素的化合价×原子个数之和 = 0 七、根据化学式的简单计算 (1)计算相对分子质量【以物质A2B3为例】 【公式】:A的相对原子质量×A的原子个数+B的相对原子质量×B的原子个数 求CaCO3的相对分子质量? 求NH4NO3的相对分子质量 解: CaCO3的相对分子质量为: 解:NH4NO3的相对分子质量为: 40+12+16X3 14+1X4+14+16X3 =100 =80 求(NH4)2CO3的相对分子质量 求2H2O的相对分子质量 【H-1;C-12;N-14;O-16】 【H-1;O-16;Ca-40】 解:(NH4)2CO3的相对分子质量为: 解: 2H2O的相对分子质量为: (14+1X4)X2+12+16X3 2×(1×2+16) =96 =36 (2)求化合物中原子个数比【以物质A2B3为例】 数出每种元素右下角的数目之比【公式】:A: B=2:3 求CaCO3中各原子个数比 求NH4NO3中各原子个数比 求(NH4)2CO3中各原子个数比 解:Ca:C:O=1:1:3 解:N:H:O=2:4:3 解:N:H:C:O=2:8:1:3 (3)计算物质组成元素的质量比【以物质A2B3为例】 【公式】:A的相对原子质量×A的原子个数:B的相对原子质量×B的原子个数 求CaCO3中各元素的质量比 求NH4NO3中各元素的质量比 【H-1;O-16;Ca-40】 【H-1;N-14;O-16】 解:Ca:C:O=40:12:16X3 解:N:H:O=14X2:1X4:16X3 =10:3:12 =7:1:12 求(NH4)2CO3中各元素的质量比 解:N:H:C:O=14X2:1X8:12:16X3 =7:2:3:12 (4)计算化合物中某元素的质量分数【以物质A2B3为例】 【公式】 自然界的水小结: 1. 水(1)水的组成 测定方法和原理(电解水) 结论:水是由氢氧元素组成的,H2(负极)与O2(正极)的体积比为2:1,质量比为1:8。 (2)自来水的净化过程和净化原理 沉淀——过滤——吸附——消毒。 活性炭作用:吸附(色素和异味)。 区分硬、软水方法:肥皂水。 水的两种软化方法:(生活中)煮沸,(实验室)蒸馏。 2. 物质分类 混合物: 由两种或两种以上纯净物组成,各物质都保持原来的性质。 纯净物: 由一种物质组成。 单质: 由同种元素组成的纯净物。 化合物: 由不同种元素组成的纯净物。 氧化物: 由两种元素组成的化合物中,其中有一种元素是氧元素。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版