【初中化学】人教版九年级上册 第三单元 物质构成的奥秘
 2021-10-05
2021-10-05 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
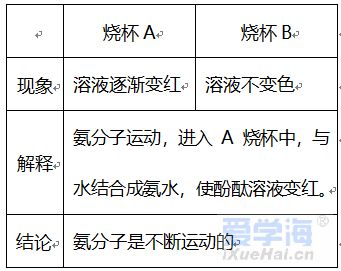
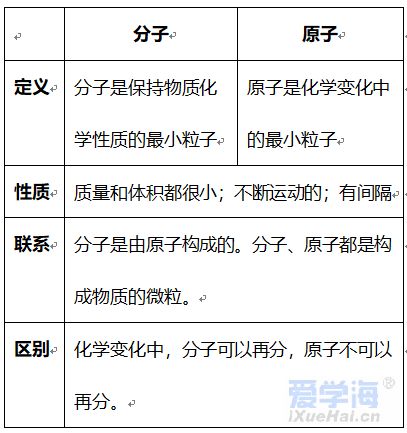
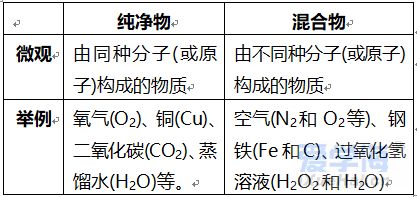
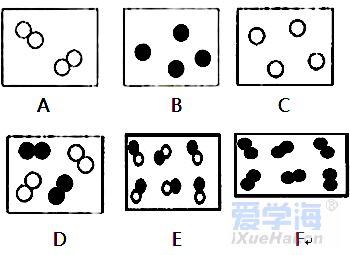
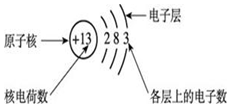
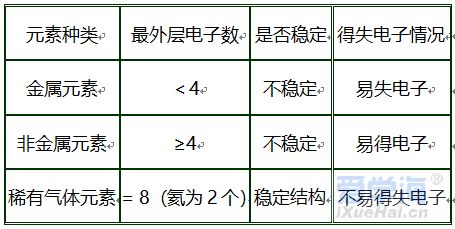
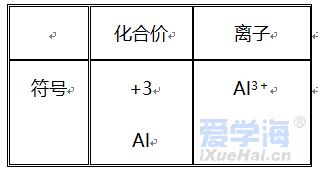
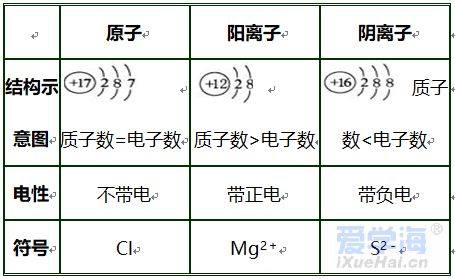
第三单元 物质构成的奥秘 【微观】 1、物质是由分子、原子、离子三种微粒构成的。水(H2O)是由水分子构成的; 2、铁(Fe)是由铁原子构成的;氯化钠(NaCl)由钠离子(Na+)和氯离子(Cl-)构成的。 3、分子是由原子构成的。如:水分子(H2O)是由氢原子和氧原子构成的。 4、1个水分子(H2O)是由2个氢原子和1个氧原子构成的。 物质由元素组成。如:水是由氢元素和氧元素组成的。 课题 1 分子与原子 一、分子 【概念】分子是保持物质化学性质的最小粒子。 例如:保持水的化学性质的最小粒子是水分子 【分子的基本性质】 ①分子的质量和体积都很小; 例如:1个水分子的质量约是1.67×10-21Kg 1mL水中大约有1.67×1021 个水分子。 例如:能闻到花的香味。 ③分子间有间隔;(分子间的间隔受热增大,遇冷缩小,气态物质分子间的间隔最大)。 例如:气体可以压缩存于钢瓶中。例如:100mL酒精加100mL水得到的溶液小于200mL。 (同种分子间的间隔相同;不同种分子间的间隔不相同)。 例如:100mL酒精加100mL酒精得到200mL酒精。 ④同种物质的分子化学性质相同,不同种物质的分子化学性质不同。 例如:O2能支持燃烧,而CO2却不能支持燃烧。 【注】:分子的大小不能改变 【氨分子运动实验】 二、原子 【概念】原子是化学变化中的最小粒子。 由原子直接构成的物质 1、金属单质,如:铁、铜等 2、固体非金属单质,如:硫、碳等 3、稀有气体单质,如:氦气、氖气等。 分子和原子的区别与联系 三、用分子和原子的观点解释 课题 2 原子的构成 一、原子的构成 一般情况下,构成原子的粒子有质子、中子、核外电子。 相对原子质量的定义公式:某原子的相对原子质量= 【注】:相对原子质量是个比值,不是原子的实际质量。单位是“1”,省略不写。 原子的质量主要集中在原子核上。因此:相对原子质量=质子数+中子数 二、核外电子的排布 原子核外电子是分层排布的,可用原子结构示意图表示 此结构图是铝原子的结构示意图;有3层电子层; 质子数为13,核电荷数为13,核外电子数为13; 第一层电子数为2;最外层电子数为3。 【排布规律】离核越近的电子能量较低,离核越远的电子能量较高, 1、决定元素种类 质子数(核电荷数) 2、决定元素化学性质 最外层电子数 3、决定原子的质量 原子核 三、离子 【概念】带电的原子(或原子团)叫做离子, 如:Na+、S2-、SO42- 离子分为阳离子和阴离子 带正电荷的原子(或原子团)叫做阳离子。如: H+ 、 Mg2+ 、Al3+ 、NH4+ 带负电荷的原子(或原子团)叫做阴离子。如: O2- 、Cl-、NO3- 【书写】在元素符号的右上角标出所带的电荷数,数值在前+-号在后,1可以省略不写。如:H+ Fe3+ Cl- S2- 【书写依据】同种元素的化合价数与离子的电荷数相等 原子、阳离子、阴离子的判断: 课题 3 元素 【概念】质子数(即核电荷数)相同的一类原子的总称。 地壳中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。 牛奶包装袋中的说明:钙≥150mg/100mL中的钙是指钙元素。 【注】:元素只讲种类,不讲个数。如:水(H2O)含有2种元素。 应用于描述物质的宏观组成。如:水(H2O)是由氢元素和氧元素组成的。 在化学反应前后元素种类不变 【元素符号表示的意义】 ⑴表示一种元素; ⑵表示这种元素的一个原子。 (3)由原子构成的物质还表示这种物质。 Cu:①铜元素;②一个铜原子;③铜。 【元素分类】金属元素、非金属元素和稀有气体元素 金属元素除“汞”以外都是“金”旁,非金属元素“石”、“气”、“氵”等偏旁 二、元素周期表 7横行(7个周期)各周期电子层数相同, 【同一周期的规律】 ①周期数=电子层数; ②从左至右元素原子的质子数依次递增。 18纵行(16族)各族最电外层电数相同, 【同一周期的规律】 同一族从上到下,元素原子的电子层数逐渐增加 三、符号的意义 总结:物质构成的奥秘 1. 分子(1)概念:由分子构成的物质,分子是保持物质化学性质最小的微粒,化学变化中可分。 (2)三个基本性质(一小二动三间隔)。 (3)影响因素(温度、压强)。 2. 原子(1)概念:原子是化学变化中的最小微粒,化学变化中不可分 。 (2)三个基本性质(一小二动三间隔)。 (3)构成:原子核(质子〔+〕、中子)和核外电子〔-〕。 核电荷数=质子数=核外电子数=原子序数 相对原子质量≈质子数+中子数 3. 离子 (1)概念:带电的原子或原子团。 (2)表示方法及意义:如Fe3+:一个铁离子带3个单位正电荷。 4. 元素 (1)概念:具有相同核电荷数(质子数)的一类原子的总称。 (2)质子数决定元素种类。 (3)元素的化学性质与原子最外层电子数密切相关。 注:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)。最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)。 5. 化合价和化学式(1)化合价 a. 写法及意义: MgCl2:氯化镁中镁元素化合价为+2价。 b. 几种数字的含义: Fe2+:每个亚铁离子带两个单位正电荷。 3 Fe2+:3个亚铁离子。 c. 化合物中各元素正、负化合价的代数和为零,单质中元素化合价为零。 (2)化学式 ① 写法: a. 单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2。 b. 化合物:正价在前,负价在后(NH3、CH4除外)。 ② 意义: 如化学式H2O的意义:4点; 化学式 Fe的意义:3点。 ③ 计算: a. 计算相对分子质量=各元素的相对原子质量×原子个数之和。 b. 计算物质组成元素的质量比:相对原子质量×原子个数之比。 c. 计算物质中某元素的质量分数。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版