【初中化学】人教版九年级上册 第二单元 我们周围的空气
 2021-10-05
2021-10-05 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
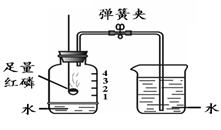
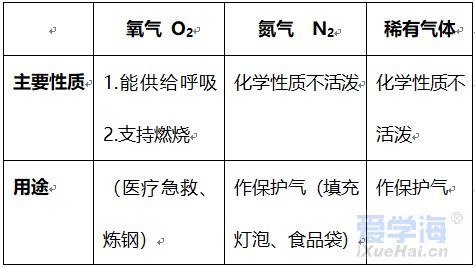
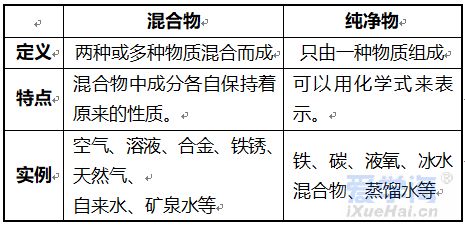
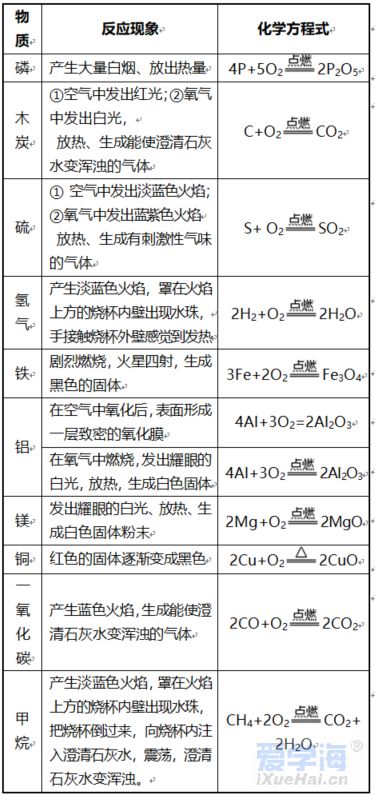
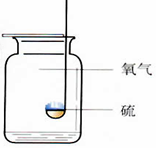
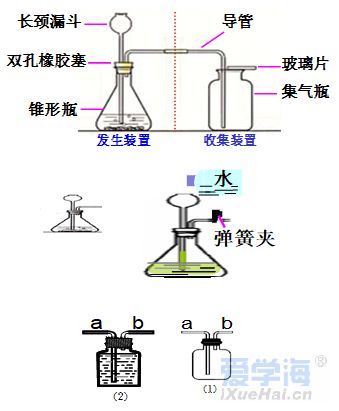
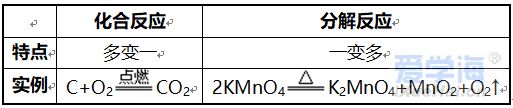
第二单元 我们周围的空气 课题 1 空 气 空气的组成: N2:78%、O2:21%、稀有气体:0.94%、CO2:0.03%,其它气体与杂质 0.03%。 一、测定空气中氧气的含量实验 【实验原理】4P+5O2 点燃 2P2O5 【实验装置】如图,集气瓶内放少量水的作用:加快集气瓶冷却;吸收生成的五氧化二磷。并分5等份。 【实验步骤】 ①检查装置的气密性。 ②点燃燃烧匙内的红磷,立即伸入集气瓶中,并塞紧橡胶塞。 ③待红磷熄灭并冷却后,打开弹簧夹。 【实验现象】 ①产生大量白烟, 放出热量; ②冷却后打开弹簧夹,可观察到:烧杯中的水倒流到集气瓶内,约占瓶体积的1/5。 【实验结论】氧气约占空气体积的1/5。 1.红磷必须过量的原因:把瓶内的氧气完全消耗。 2. 要先夹住橡胶管,然后再点红磷。 【思考】 不能用碳、硫代替红磷。原因:因为碳和硫燃烧后产物是气体,瓶内压强没有明显变化。 不能用铁代替红磷。原因:铁不能在空气中燃烧。 【测量结果偏小的原因】 ①装置漏气; ②红磷用量不足; ③未冷却就打开弹簧夹。 【测量结果偏大的原因】: ①弹簧夹没有夹紧; ②燃烧匙伸入太慢。 【推测】 ①氮气难溶于水; ②氮气不能燃烧也不支持燃烧。 二、空气是一种宝贵的资源 三、空气的污染及防治 【污染】 ①有害气体:二氧化硫(SO2)、二氧化氮(NO2)、一氧化碳(CO) ②烟尘: 环境污染问题:温室效应(二氧化碳含量过多而引起);酸雨(二氧化硫、二氧化氮而引起)。 【防治】 ①加强大气质量监测; ②减少使用化石燃料燃烧,开发清洁能源; ③植树造林; ④工厂的废气必须处理达标后才排放。 四、物质的分类 课题 2 氧气 【物理性质】不易溶于水;密度比空气大。 【化学性质】氧气的化学性质比较活泼。能供给呼吸、支持燃烧。 氧化反应:物质与氧(氧元素)发生的反应。 氧化反应分为:剧烈氧化反应和缓慢氧化反应 常见物质与氧气的反应 1、木炭燃烧实验 【注意事项】 ①将木炭放在酒精灯加热的原因:使木炭的温度达到着火点。 ②发红的木炭应由瓶口向下缓慢伸进盛有氧气的集气瓶中的原因:防止还没有反应的O2受热膨胀而逸出,会降低瓶中氧气的含量。 2、硫燃烧实验 【注意事项】在集气瓶底放入少量水的原因:吸收生成的二氧化硫,防止污染空气。 3、细铁丝在氧气中燃烧实验 【注意事项】 ①用砂纸把细铁丝磨成光亮的原因:除去表面的铁锈。 ②将细铁丝盘成螺旋状的原因:增大细铁丝与氧气的接触面积。 ③在细铁丝下端系一根火柴的原因:引燃细铁丝。 ④待火柴快燃尽时才插入盛有氧气的集气瓶中的原因:防止火柴燃烧消耗过多的氧气。 ⑤在集气瓶底放入少量水的原因:防止生成的熔化物溅落炸裂瓶底。 课题 3 实验室制取氧气 一、加热高锰酸钾制取氧气 【药品】:高锰酸钾(KMnO4暗紫色固体) 【原理】:2KMnO4≜K2MnO4+MnO2+O2↑ 【发生装置】:固体反应且需加热 【收集装置】: ①排水法收集。原因:氧气不易溶于水。 ②向上排空气法收集。原因:氧气的密度比空气大。 【操作步骤】:(连)查、装、定、点、收、移、熄 (1)(查)检查装置气密性。 操作:将导管一端浸入水里,用手紧握试管外壁,若导管口有气泡冒出,松开手后,导管内形成一段稳定的水柱,则说明装置不漏气。 (2)(装)装药品,(放棉花的作用:防止加热时高锰酸钾粉末进入导管),塞上带导管的橡胶塞。 (3)(定)固定试管在铁架台上。(试管口要略向下倾斜的原因:防止冷凝水回流到热的试管底部,使试管炸裂) (4)(点)点燃酒精灯加热(操作:先预热,用酒精灯火焰在试管下方来回移动,再把外焰集中在药品的部位加热) (5)(收)收集气体。(当气泡连续均匀地冒出时才收集的原因:刚冒出的气泡是空气,若收集则气体不纯) (6)(移)先将导管移出水面。(原因:防止水倒吸到试管底部,使热的试管炸裂) (7)(熄)后熄灭酒精灯。 【贮存】:正放在桌面上。(原因:氧气的密度比空气大) 【检验】:将带火星的木条伸入集气瓶中,若木条复燃,则证明该气体是氧气。 【验满】:将带火星的木条放在集气瓶口,若木条复燃,则证明氧气已集满。 二、过氧化氢溶液与二氧化锰制取氧气 【药品】:过氧化氢(H2O2)和二氧化锰(黑色粉末 MnO2) 二氧化锰能加快过氧化氢的分解速率,起催化作用。 【发生装置】:固液反应且不需加热 【收集装置】: ①排水法收集; ②向上排空气法收集。 检查装置气密性: 用弹簧夹夹紧橡胶管,向长颈漏斗中加水,形成液封后,若长颈漏斗下端形成一段稳定的水柱,则说明装置的气密性良好。 【注意事项】 ①长颈漏斗的下端必须插入液面下。(原因:防止生成的气体从长颈漏斗中逸出) ②导管口要伸到接近集气瓶的底部。(原因:把瓶内的空气完全排出,防止收集的气体不纯) 图⑴为排空气法收集气体:密度比空气大的气体应从a导入(即空气从顶出) 图⑵为排水法收集气体:气体应从b导入(即水从底流出) 三、加热氯酸钾与二氧化锰制取氧气 【药品】:氯酸钾(KClO3)和二氧化锰 【原理】 催化剂概念:在化学反应中能改变其他物质的反应速率(加快或减慢),而本身的质量和化学性质在反应前后没有发生变化的物质。 【特点】:一变(反应速率)两不变(质量、化学性质) 【回收】:待反应后过滤、洗涤、烘干 【注意事项】 ①催化剂不参加反应; ②催化剂仅针对某一反应,并不是所有反应的催化剂。 四、工业上制取氧气 【方法】:分离液态空气法。属于物理变化。 五、反应的基本类型 六、空气中氧气的测定(原理:压强差) (1) 可燃物要求:足量且产物是固体,红磷。 (2) 装置要求:气密性良好 操作要求:冷却到室温后打开弹簧夹。 (3) 现象:放热,有大量白烟产生,打开弹簧夹后,广口瓶内液面上升约1/5体积。 (4) 结论:O2约占空气体积的1/5。(5) 探究: ① 液面上升小于1/5原因:装置漏气,红磷量不足,未冷却完全。 ② 能否用铁、镁代替红磷? 不能,原因:铁不能在空气中燃烧,镁会与N2、CO2反应。 ③ 能否用碳、硫代替红磷? 不能,原因:产物是气体,不能产生压强差。 七、氧气的性质和制备 (1)氧气的化学性质:支持燃烧,供给呼吸。 铁在氧气中燃烧烧集气瓶中放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底。 硫在氧气中燃烧集气瓶中放入少量水的目的:吸收SO2,防止其污染空气。 ▪ (2)氧气的制备: ① 工业制氧气——分离液态空气法(原理:液氮和液氧的沸点不同,物理变化) ② 实验室制氧气原理: a. 气体制取与收集装置的选择 发生装置:固固加热型、固液不加热型 (根据反应物的状态和反应条件) 收集装置:根据气体的密度、溶解性。 b. 制取氧气的操作步骤(以高锰酸钾制取氧气并用排水法收集为例)查—装—定—点—收—离—熄。 c. 催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。(一变两不变)。 八、常见气体的用途: (1)氧气:供呼吸 (如潜水、医疗急救)。 支持燃烧 (如燃料燃烧、炼钢、气焊)。 (2)氮气:保护气(化性不活泼)、重要原料(硝酸、化肥)、液氮冷冻。 (3)稀有气体(He、Ne、Ar、Kr、Xe等的总称):保护气、电光源(通电发不同颜色的光)、激光技术。 九、常见气体的检验方法 (1)氧气:带火星的木条。 (2)二氧化碳:澄清的石灰水。 (3)氢气:将气体点燃,用干冷的烧杯罩在火焰上方;或者,先通过灼热的氧化铜,再通过无水硫酸铜。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版