【高中物理】高三物理 原子和原子核
 2021-10-08
2021-10-08 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
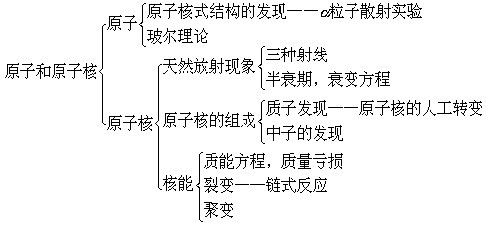
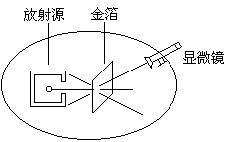
一、原子结构: 1、电子的发现和汤姆生的原子模型: 1897年英国物理学家汤姆生,对阴极射线进行了一系列的研究,从而发现了电子。电子的发现表明:原子存在精细结构,从而打破了原子不可再分的观念。 1903年汤姆生设想原子是一个带电小球,它的正电荷均匀分布在整个球体内,而带负电的电子镶嵌在正电荷中。 2、.粒子散射实验和原子核结构模型 ①装置: a.绝大多数.粒子穿过金箔后,仍沿原来方向运动,不发生偏转。 b.有少数.粒子发生较大角度的偏转. c.有极少数.粒子的偏转角超过了90度,有的几乎达到180度,即被反向弹回。 (2)原子的核式结构模型: 1911年,卢瑟福通过对a粒子散射实验的分析计算提出原子核式结构模型: 在原子中心存在一个很小的核,称为原子核,原子核集中了原子所有正电荷和几乎全部的质量,带负电荷的电子在核外空间绕核旋转。 3、玻尔的原子模型 即mvr=n h/2π . n=1、2、3…… 
|
上一篇:【高中物理】高三物理 气体的性质
下一篇:【高中物理】高三物理 恒定电流
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版