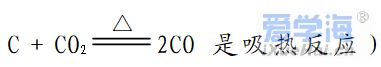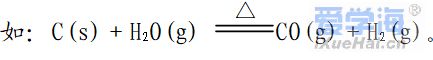【高中化学】高一必修二 专题二 第二单元 化学反应中的热量
 2021-10-01
2021-10-01 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
1、在任何的化学反应中总伴有能量的变化。 原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。E反应物总能量>E生成物总能量,为放热反应。E反应物总能量<E生成物总能量,为吸热反应。 2、常见的放热反应和吸热反应 ☆ 常见的放热反应:①所有的燃烧与缓慢氧化 ② 酸碱中和反应 ③ 大多数的化合反应 ④ 金属与酸的反应 ⑤ 生石灰和水反应(特殊: ☆常见的吸热反应:①铵盐和碱的反应 如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O ②大多数分解反应如KClO3、KMnO4、CaCO3的分解等 ③ 以H2、CO、C为还原剂的氧化还原反应 ④ 铵盐溶解等 3.产生原因:化学键断裂——吸热 化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 4、放热反应、吸热反应与键能、能量的关系 放热反应:∑E(反应物)>∑E(生成物) 其实质是,反应物断键吸收的能量<生成物成键释放的能量,∆H<0。可理解为,由于放出热量,整个体系能量降低 吸热反应:∑E(反应物)<∑E(生成物) 其实质是:反应物断键吸收的能量>生成物成键释放的能量,∆H>0。可理解为,由于吸收热量,整个体系能量升高。 5、热化学方程式 书写化学方程式注意要点: ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 |
- 【高中化学】高一 专题四 化学科学与人类文明
- 【高中化学】高一 专题三有机化合物的获得与应用 二、食品中的有..
- 【高中化学】高一 专题三 有机化合物的获得与应用 一、 烃
- 【高中化学】高一必修二 专题二 第二单元 化学反应中的热量
- 【高中化学】高一必修二 专题二 第四单元 太阳能、生物质能和氢..
- 【高中化学】高一必修二 专题二 第一单元 化学反应的速率与反应..
- 【高中化学】高一必修二 专题二 第三单元 化学能与电能的转化
- 【高中化学】高一必修二 第三单元 从微观结构看物质的多样性
- 【高中化学】必修二第一单元 原子核外电子排布与元素周期律
- 【高中化学】必修一 第四章 非金属及其化合物 习题
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版