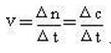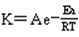【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学反应的速率
 2021-10-06
2021-10-06 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
1、化学反应是怎样进行的 2、化学反应速率 3、浓度对反应速率的影响 4、温度对化学反应速率的影响 5、催化剂对化学反应速率的影响 |
- 【高中化学】高二 第1章 化学反应与能量转化 一、化学反应的热效..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 二、化学..
- 【高中化学】高二 第1章 化学反应与能量转化 三、化学能转化为电..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 一、化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
- 【高中化学】高二 第1章 化学反应与能量转化 二、电能转化为化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 二、弱电解质的..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 四、化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平..
- 【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
- 【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平..
- 【高中化学】高二 第3章、物质在水溶液中的行为 二、弱电解质的..
- 【高中化学】高二 第3章、物质在水溶液中的行为 一、水溶液
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 四、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 二、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 一、化学..
- 【高中化学】高二 第1章 化学反应与能量转化 三、化学能转化为电..
- 【高中化学】高二 第1章 化学反应与能量转化 二、电能转化为化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
- 【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平..
- 【高中化学】高二 第3章、物质在水溶液中的行为 二、弱电解质的..
- 【高中化学】高二 第3章、物质在水溶液中的行为 一、水溶液
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 四、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 二、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 一、化学..
- 【高中化学】高二 第1章 化学反应与能量转化 三、化学能转化为电..
- 【高中化学】高二 第1章 化学反应与能量转化 二、电能转化为化学..
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版