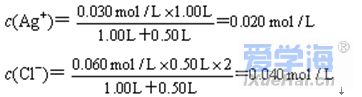【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
 2021-10-06
2021-10-06 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
1、离子反应发生的条件 2、离子反应能否进行的理论判据 3、离子反应的应用 例1、在一定条件下,将2mol/LSO2和1mol/LO2放入密闭容器中反应:2SO2+O2⇄2SO3,在2s时测得物质的量浓度c(SO2)=0.8mol/L。求用SO2、O2、SO3表示该反应的速率分别是多少? 例2、25℃下,在1.00L、0.30mol/LAgNO3溶液中加入0.50L、0.060mol/L的CaCl2溶液,能否生成AgCl沉淀,生成AgCl的质量是多少?最后溶液中c(Ag+)为多少? 试回答下列问题: (1)这包粉末中肯定不存在的离子是 ;肯定存在的离子是 。 (2)写出试验①中有关的离子方程式 ,实验②中的化学方程式 。 解析:因溶液无色透明,肯定无Fe3+,用硝酸酸化无明显现象,肯定无S2-和HCO3-。加Ba(NO3)2无现象说明没有SO42-;加AgNO3溶液有白色沉淀产生,说明存在Cl-;加铜片浓硫酸共热,有红棕色气体产生,也不能说明原溶液有NO3-,因为加硝酸酸化时引入了NO3-;焰色反应呈浅紫色说明有K+。 答案:(1)Fe3+、S2-、HCO3-、SO42-;Cl-、K+; (2)Ag++Cl-=AgCl↓ KNO3+H2SO4(浓)≜HNO3+KHSO4; Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O |
上一篇:【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平衡
下一篇:没有了
- 【高中化学】高二 第1章 化学反应与能量转化 一、化学反应的热效..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 二、化学..
- 【高中化学】高二 第1章 化学反应与能量转化 三、化学能转化为电..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 一、化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
- 【高中化学】高二 第1章 化学反应与能量转化 二、电能转化为化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 二、弱电解质的..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 四、化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平..
- 【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
- 【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平..
- 【高中化学】高二 第3章、物质在水溶液中的行为 二、弱电解质的..
- 【高中化学】高二 第3章、物质在水溶液中的行为 一、水溶液
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 四、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 二、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 一、化学..
- 【高中化学】高二 第1章 化学反应与能量转化 三、化学能转化为电..
- 【高中化学】高二 第1章 化学反应与能量转化 二、电能转化为化学..
- 【高中化学】高二 第3章、物质在水溶液中的行为 四、离子反应
- 【高中化学】高二 第3章、物质在水溶液中的行为 三、沉淀溶解平..
- 【高中化学】高二 第3章、物质在水溶液中的行为 二、弱电解质的..
- 【高中化学】高二 第3章、物质在水溶液中的行为 一、水溶液
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 四、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 三、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 二、化学..
- 【高中化学】高二 第2章、化学反应的方向、限度与速率 一、化学..
- 【高中化学】高二 第1章 化学反应与能量转化 三、化学能转化为电..
- 【高中化学】高二 第1章 化学反应与能量转化 二、电能转化为化学..
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版