【高中化学试卷】高一化学期末复习(一)
 2021-12-17
2021-12-17 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
(时间:75分钟 满分:100分) 一、选择题(本题包括16小题,每小题只有一个选项符合题意,1~10题每小题2分,11~16题每小题4分,共44分) 1.下列物质中,不能由Cl2直接反应制得的是( ) A.CuCl2 B.FeCl2 C.Ca(ClO)2 D.NaCl 2.(2019·广东学业考试)某医用氧气瓶中储有0.5 mol氧气,该氧气在标准状况下的体积为( ) A.0.5 L B.11.2 L C.22.4 L D.44.8 L 3.(2019·广东学业考试)水体中溶解的O2对渔业养殖有重要作用。已知某水体中溶解的O2的浓度为6.4 mg/L,则1 m3水中溶解的O2的物质的量为( ) A.0.1 mol B.0.2 mol C.0.4 mol D.2.0 mol 4.(2019·广东学业考试)室温常压下,将9.0 g葡萄糖(相对分子质量为180)完全溶解于100.0 g水中(假设溶解后体积不变)。对该溶液描述正确的是( )
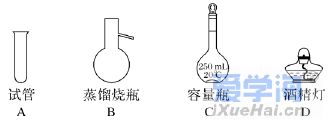
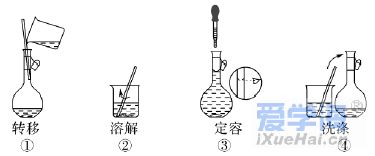
5.(2019·福建学业考试)实验室中配制250mL 0.1 mol·L-1 NaCl溶液,需要用到的仪器是( ) 6.(2019·浙江学业考试)配制500 mL 0.100 mol·L-1的NaCl溶液,部分实验操作示意图如下: 下列说法正确的是( ) A.实验中需用到的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等 B.上述实验操作步骤的正确顺序为①②④①③ C.容量瓶需用自来水、蒸馏水洗涤,干燥后才可用 D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低 7.下列物质与其俗名匹配且相关叙述合理的是( ) A.磁性氧化铁:四氧化三铁,为黑色晶体 B.铁红:氧化亚铁,可用作红色油漆的颜料 C.双氧水:过氧化氢,受热稳定、易溶于水 D.苏打:碳酸氢钠,可用于治疗胃酸 8.(2020·贵州遵义高一期末考试)药品“速力菲”中Fe2+会被空气缓慢氧化,国家规定如果药物中有超过10%的Fe2+被氧化即不可服用。若要证明该药是已被氧化,下列试剂能达到实验目的的是( ) A.新制氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.KCl溶液 9.(2019·广东学业考试)一定量Cl2通入足量的水中,发生反应Cl2+H2O===HClO+HCl,能说明该反应的产物中可能含有Cl-的是( ) A.氯水具有漂白作用 B.氯水可以与FeSO4溶液反应 C.氯水具有杀菌消毒作用 D.氯水可与AgNO3溶液反应 10.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( ) ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中 A.②③①④ B.③②①④ C.③①②④ D.①②③④ 11.(2019·广东学业考试)氯及其化合物广泛用作纺织、造纸的漂白剂和城市供水的消毒剂。Cl2与H2O可发生如下反应:Cl2+H2O===HClO+HCl,下列说法正确的是( ) A.H2O被氧化 B.HClO见光易分解 C.HCl有漂白性 D.Cl2只是氧化剂 12.下列说法正确的是( ) A.22.4 L H2中一定含有2mol H B.16 g O2所含O的物质的量为2 mol C.1 mol OH-含有的电子数为6.02×1023 D.20 ℃、1.0×105 Pa时,同体积的O2与CO2含有相同的分子数 13.下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( ) 14.(2020·天津一中高一月考)设NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A.标准状况下,28g N2和CO的混合气体所含分子数为2NA B.1.8 g NH+4中含有的电子数为1.1NA C.标准状况下,18g H2O含有的原子数为3NA D.1 L 1 mol/L的盐酸中含有NA个HCl分子 15.下列实验方案能够达到目的的是( )
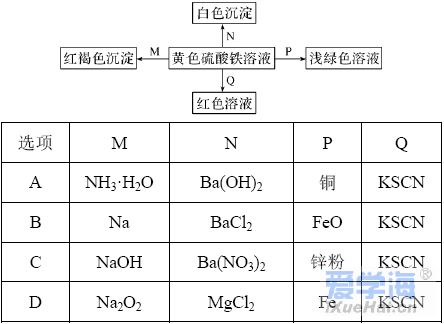
16.下表中对离子方程式书写的评价正确的是( )
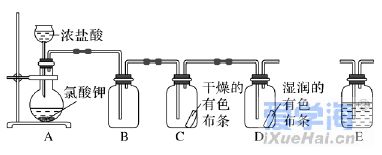
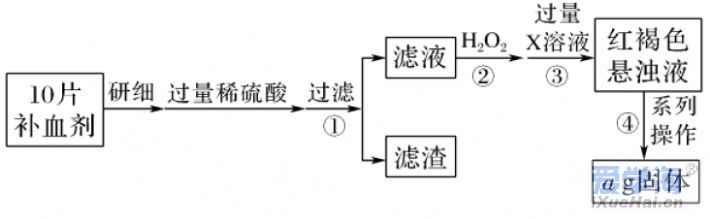
二、非选择题(本题包括4小题,共56分) 17.(14分)生产生活中常用“84”消毒液杀菌消毒。化学课外小组用Cl2和NaOH固体制取“84”消毒液。请回答下列问题: (1)制取“84”消毒液的离子方程式为______________________________________。 (2)制取“84”消毒液需要4.0mol·L-1的NaOH溶液100 mL,配制时称量NaOH固体的质量为 ,配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。 (3)该消毒液也用于漂白,为增强漂白性向消毒液中滴加几滴稀盐酸,写出化学反应方程式______________________________________________。 (4)“84”消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,化学课外小组同学向溶液中滴加紫色石蕊试液,出现 现象,证明消毒液已失效。 18.(14分)实验室欲配制浓度均为0.1 mol·L-1的NaOH和Na2CO3的混合溶液。 现实验室有以下仪器: ①玻璃棒 ②烧杯 ③托盘天平④量筒 ③药匙 ⑥胶头滴管 ⑦500 mL容量瓶⑧标签纸 ⑨细口试剂瓶。 根据以上提供的仪器,回答下列问题。 (1)分别用托盘天平称量m(NaOH)=_______ g,m(Na2CO3)=______g,Na2CO3可放在称量纸上称量,NaOH需放在______中称量。 (2)加水溶解,冷却至室温后将溶液转移到容量瓶中,转移溶液至容量瓶中时,有部分液体流到容量瓶外壁,则配制的溶液浓度将_______(填“偏高”、“偏低”或“无影响”)。 (3)洗涤,定容:加蒸馏水至离刻度线1~2 cm时,改用______(填仪器名称)向容量瓶中加蒸馏水至凹液面与刻度线相切。 (4)摇匀、装瓶。取出任意体积的该溶液时,下列物理量中不随所取体积的多少而变化的是_______(填标号)。 A.溶液中Na2CO3的物质的量 B.溶液中NaOH的浓度 C.溶液中OH-的数目 D.CO2-3与OH-的浓度之比 (5)取出50 mL配制的溶液,向其中加入0.300mol·L-1的盐酸,反应至无气体放出,则消耗的盐酸的体积为__________mL。 (6)取出上述配制的溶液10 mL,加水稀释至30mL时,稀释后c(Na+)=________ mol·L-1。 19.(14分)某同学通过查阅资料得知,常温下KClO3和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取Cl2并探究其有关性质: (1)装置A中存在一处错误,改正这处错误:____________________________。 (2)配平装置A中发生反应的化学方程式: ______KClO3+________ HCl(浓)===_________ KCl+______ Cl2↑+____________ H2O。 (3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入________(填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为_________(填序号)。 a.A、B之间 B.B、C之间 c.C、D之间 D.D之后 (4)将氯气通入冷的石灰乳中,即可制得以________(填化学式)为有效成分的漂白粉,发生反应的化学方程式为_______________________________________。 (5)有同学认为,上述装置还有另外一处的缺陷,并给出了改进措施。该改进措施是________________________________________________________。 20.(13分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: 请回答下列问题: (1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有________(填离子符号)。 (2)操作②中反应的离子方程式:_____________________________________。 (3)操作③中反应的离子方程式:_____________________________________。 (4)操作④中一系列处理的操作步骤:过滤、________、灼烧、________、称量。 (5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为________ g。(用含a的代数式表示)
|
上一篇:没有了
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版