高一化学第一学期教学质量监测试卷(二)
 2022-02-06
2022-02-06 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
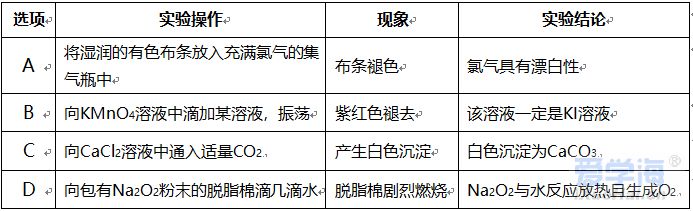
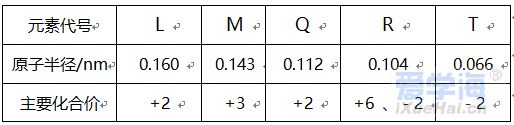
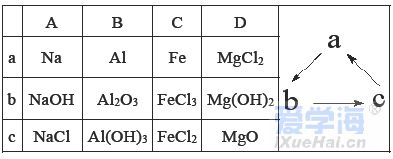
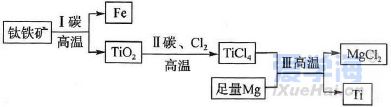
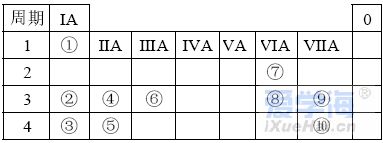
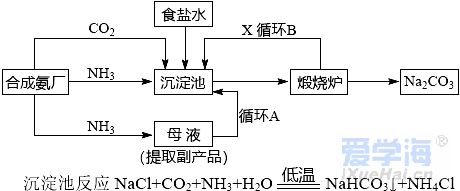
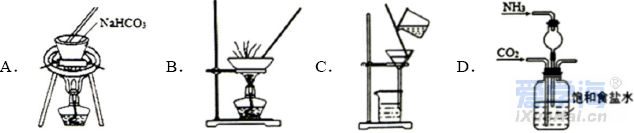
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al-27 Cl-35.5 Fe-56 一、选择题:本题共10小题,每小题2分,共20分,每小题只有一个选项符合要求。 1.下列物质属于电解质的是() A.蔗糖溶液 B.铝 C.KOH D.乙醇 2.从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是() A. 金属活动性及冶炼的难易程度 B. 金属的导电性 C. 金属的延展性 D. 地壳中金属元素的含量 3. 下列叙述不正确的是() A.用砂纸打磨过表面的铝箔,加热熔化后但不滴落,说明A12O3的熔点比铝的高; B.铁在潮湿的空气中生成的氧化物结构不致密,不能保护内层金属,故铁制品往往需涂保护层; C.铝锅使用过程中,能经受高温的考验,故铝是不活泼金属; D.钠与水的反应中,钠块熔成小球,说明该反应为放热反应。 4.设NA为阿伏加德罗常数的值,下列叙述正确的是() A.32g O2和O3混合气体所含氧原子数目为2NA B.标准状况下,2.24L H2O含有的原子数为0.3NA C.2mol/L的FeCl3溶液,其中含有Cl-为6NA D.在常温常压下,11.2L N2含有的分子数为0.5NA 5.下列有关“实验操作”、“现象”及“实验结论”都正确的是() 6.于敏院士完成了氢弹最关键的基本构型设计,外媒称中国的氢弹构型为“于敏构型”。239Pu是“于敏型”氢弹的重要原料,下列说法正确的是() A. 239Pu原子的原子核中含有239个质子 B.239Pu 衰变成235U 属于化学变化 C. 238Pu 、239Pu 和241Pu属于不同的核素 D.238Pu 与238U 在元素周期表中的位置相同 7.下表是部分短周期元素的原子半径及主要化合价,根据下表信息判断以下叙述正确的是() A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的剧烈程度为L<Q C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等 8.证明某溶液只含有Fe2+ 而不含Fe3+ 的最佳实验方法是() A.先滴加氯水,再滴加KSCN溶液后显红色 B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色 D.只需滴加KSCN溶液 9.实验室欲配制100mL1.00mol•L-1 Na2CO3溶液。下列有关叙述中,正确的是() A.称取10.6g Na2CO3固体 B.将Na2CO3固体放入容量瓶中,加水至刻度线,摇匀 C.定容时俯视液面,所得溶液浓度偏低 D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 10 .下列关于化学键的说法正确的是() A.构成单质分子的微粒一定含有共价键 B.全部由非金属元素组成的化合物中可能含有离子键 C.非极性键只存在于非金属单质或共价化合物中 D.由不同种元素组成的多原子分子里,一定只存在极性键 二、选择题:本题共8小题,每小题3分,共24分,每小题只有一个选项符合要求。 11.Na、Mg、Al、Fe是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“ →”表示一步完成)相互转化的是() 12.向含有FeCl3、FeCl2的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是() A.该分散系的分散质为Fe2O3 B.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 C.可用过滤的方法将黑色金属氧化物与Na+分离开 D.加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-=Fe3O4(胶体)+4H2O 13 .下列关于含氯消毒剂的描述或解释不正确的是() A.“84”消毒液不能与洁厕灵混合使用:2H++Cl-+ClO-=Cl2↑+H2O B.将氯气通入澄清石灰水制取漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C.氯水中含有HClO,能杀死水中的病菌,起到消毒的作用 D.向Ca(ClO)2溶液中通入适量CO2:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 14 .下列离子在指定条件下的溶液中,一定能共存的是() A.在加入铝粉能产生氢气的溶液中:NH4+、Na+、Cu2+ 、HCO3 B.使石蕊变红色的溶液中:NO3-、MnO4-、K+、Fe2+ C.加入Na2O2的溶液中:Ba2+ 、Al3+ 、NO3-、Cl- D.澄清透明溶液中:K+、Fe3+ 、SO42-、Mg2+ 15.我国首艘使用了钛合金材料的国产航母已成功下水,钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图。下列说法错误的是() A.步骤Ⅰ、II中均发生氧化还原反应 B.步骤Ⅰ、Ⅱ中碳元素的化合价均升高 C.步骤Ⅲ中反应可在氩气环境中进行,也可在空气中进行 D.可用稀硫酸除去金属钛中的少量镁杂质 16.已知氧化性:Cl2>Br2>Fe3+ ,向含溶质amolFeBr2的溶液中通入bmolCl2,充分反应。下列说法不正确的是() A.离子的还原性强弱:Fe2+>Br->Cl- B.当a=2b时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl- C.当a=b时,反应后的离子浓度:c(Fe3+):c(Br-):c(Cl-)=1:2:2 D.当3a=2b时,发生的离子反应:2Fe2++4Br+3Cl2=2Fe3++2Br2+6Cl- 17.短周期主族元素X、Y、Z、W的原子序数依次增大,X的次外层电子数是其电子总数的1/4,Y是地壳中含量最高的金属元素,X与Z同一主族,WX2在疫情期间常用作消毒剂、漂白剂。下列有关叙述正确的是() A.X、Z、W形成化合物ZX2、WX2,其化学键类型不同 B.离子半径的大小关系:W->Z2->Y3+ >X2- C.X、Z形成的简单氢化物的稳定性:H2Z>H2X D.相同质量、均转化为W-时,WX2的漂白效果远强于W2 18.一定条件下,氨气和氟气发生反应:4NH3+3F2=NF3+3NH4F,其中产物NF3分子结构和NH3相似。下列有关说法错误的是( )A.NF3分子含有极性共价键 B.NF3属于共价化合物 C.氧化剂与还原剂物质的量之比3:1 D.上述反应中,反应物和生成物均属于共价分子 三、非选择题:包括19~22共四道大题,共56分。 19.(14分)下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。 针对元素①~⑩回答下列问题。 (1)其中属于卤族元素的是_______( 填元素符号);它们的气态氢化物中较稳定的是_______( 填化学式);其中属于碱金属元素的是_______( 填元素符号),它们的最高价氧化物对应的水化物中碱性较强的是_______( 填化学式)。 (2)元素②⑥⑨最高价氧化物对应的水化物之间可以两两发生反应,其中能体现水化物呈“两性” 的离子方程式分别为_______________________ 、________________________ 。 (3)能证明元素⑨⑩的非金属性强相对强弱的实验事实是_______________( 用离子方程式表示)。 (4)元素③⑤⑧⑨对应的具有稳定结构的简单离子的半径由大到小的排序为____________( 用相应的离子符号排序)。 (5)元素②的单质在元素⑦的单质中点燃生成的固态产物中包含的化学键类型有___ 种,将其投入硫酸亚铁溶液中,预测主要的反应现象是________________________ 。 (6)元素①和②的单质化合形成的化合物电子式是________ ,其与水反应的化学方程式是______________________________ 。 20.(14 分)利用“价类二维图”可以从不同角度研究含铁物质的性质及其转化关系,图中甲~己均含铁元素。回答下列问题: (2)戊与烧碱溶液反应生成丙,在空气中放置一段时间后丙转化为丁,丙转化为丁的化学方程式为______________________________________________________ 。 (3)K2FeO4常用作杀菌消毒剂,从化合价的角度分析是K2FeO4具有_______ 性。用己(FeCl3)与KClO 在强碱性条件下制取K2FeO4时,该反应中氧化剂与还原剂的物质的量之比为___________ 。 (4)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+ 的拆写结果是:氧化反应为:Cu-2e−=Cu2+ ;还原反应为:2Fe3++2e−=2Fe2+ 。请据此将上图中甲与盐酸反应的离子方程式拆写成两个“半反应式”,其中还原反应为_______________________________ 。 (5)若己和戊分别是硫酸亚铁和硫酸铁,取一定量己和戊的混合物样品溶于水,配成100mL 溶液,所得溶液分成两份,在第一份溶液中加入0.5mol/L 的氯化钡溶液220mL 恰好完全反应。在第二份溶液中通入标准状况下的氯气0.896L ,可以使Fe2+ 全部转化成Fe3+ ,若在第一份溶液中完全反应后过滤所得的滤液中再加入足量的NaOH 溶液,所得的沉淀经洗涤、空气中充分灼烧,最后残渣的质量是______g 。 21.(14 分)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(提取副产品)沉淀池反应NaCl+CO2+NH3+H2O 低温NaHCO3↓+NH4Cl (1)侯氏制碱法”誉满全球,其中的“碱”为_________ (填化学式),俗称_________ 。 (2)实验室模拟“侯氏制碱法”,下列操作未涉及的是________ 。 (3)煅烧炉中发生反应的化学方程式为_______________________________________ 。 (4)使用原料氯化钠的利用率从70% 提高到90% 以上,主要是设计了______ (填上述流程中的编号)的循环,流程中物质X 为___________ (填化学式)。 (5)该流程提取的副产品为________ (填化学式),其用途___________ (写一种)。 (6)简单的检验方案的一般叙述过程为:①取试样,②加检验试剂,③现象,④结论。为验证产品纯碱中含有杂质NaCl ,简单的检验方案是:取少量试样溶于水后,______________________ 22.(14 分)铝镁合金是飞机制造、建筑等行业的重要材料。研究性学习小组的同学,为测定某铝镁合金(不含其他元素)中铝的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白: 【方案一】将铝镁合金与足量NaOH 溶液反应,测定剩余固体质量。 (1)实验中发生反应的离子方程式是____________________________________________ 。(2)称取10.8g 铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol•L-1NaOH 溶液中,为了保证铝镁合金粉末能充分反应,则NaOH 溶液的体积V≥_______mL 。 (3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将_________( 填“偏 高”、“偏低”或“无影响”) 。 【方案二】将一定量铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。 (4)同学们拟选用下列实验装置完成实验: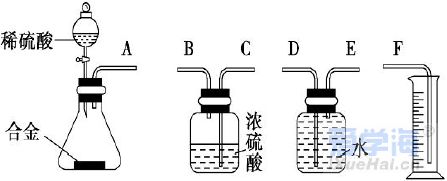 你认为最简易的装置其连接顺序是A→()→()→()→()→()(填接口字母,可不填满)。 (5)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。 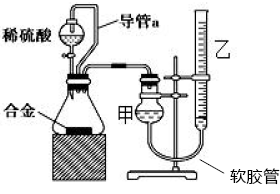 ①装置中导管a 的作用除了平衡气体压强,使分液漏斗中的稀硫酸能顺利滴下以外,从精确测量氢气体积的角度分析,还有一个作用是____________________ 。 ②已知金属与酸的反应是放热反应,为了较准确测量室温、一个标准大气压下氢气的体积,在读反应前后量气管乙中液面的读数求氢气体积的过程中,除视线平视外还应注意_____( 填字母编号)。 A.冷却至室温再读数 B.乙管中液面不再上升时应该及时读数 C.读数时应上下移动量气管乙,使甲、乙中液面左右相平 D.读数时不必使甲、乙中液面左右相平 ③若实验用铝镁合金的质量为5.1g ,测得氢气体积为5.6L( 已转换成标准状况),则合金中铝的质量分数为_____( 保留两位有效数字)。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版