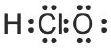高一化学第一学期教学质量监测试卷(五)
 2022-02-08
2022-02-08 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
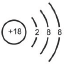
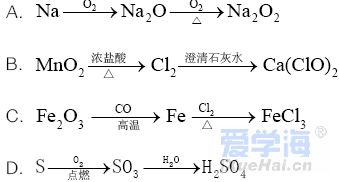
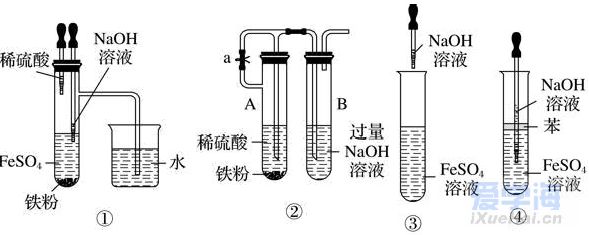
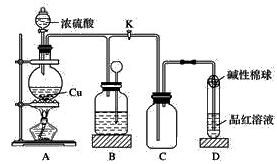
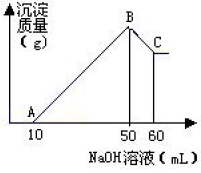
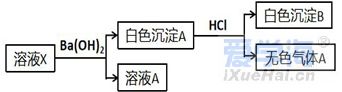
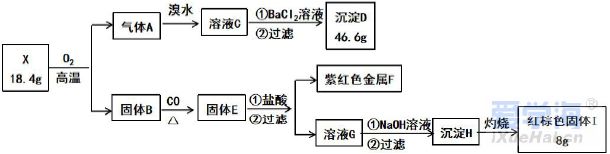
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5 Fe56 Cu64 Ba137 选择题部分 一、选择题(本大题共25小题,每小题2分,共50分。每小题列出的四个选项中只有一个是符合题目要求的,不选、多选、错选均不得分) 1. 下列物质中,属于酸性氧化物的是()A.NO B.Al2O3 C.MgO D.CO2 2. 下列仪器不能用于加热的是() 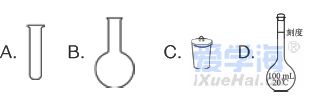 3. 下列各组物质,按化合物、单质、混合物顺序排列的是() A.碱石灰、硫磺、胆矾 B.纯碱、液氨、碘酒 C.干冰、白磷、浓硫酸 D.氯水、氦气、酒精 4. 下列物质中,含有非极性共价键的是()A.NH4Cl B.H2S C.CO2 D.Na2O2 5. 下列不属于氧化还原反应的是()A. 2Na+2H2O=2NaOH+H2↑ B. H2SO4+2NaOH=Na2SO4+2H2O C. Cl2+2NaOH=NaCl+NaClO+H2O D. 8NH3+3Cl2=6NH4Cl+N2 6. 下列化学用语使用正确的是()A.食盐晶体的分子式:NaCl B.氮气的结构式:N≡N C. 18O2- 的离子结构示意图: D. 次氯酸的电子式: A. 做金属钠的相关实验时,多余的钠要放回广口瓶 B. 焰色试验使用的铂丝也可以用细铁丝代替 C.在饱和食盐水中依次通入足量的CO2和NH3后有NaHCO3晶体析出 D.常用NaOH 溶液吸收硝酸反应的尾气NO2 8. 下列关于物质的性质与用途具有对应关系的是() A.ClO2 具有氧化性,可用作自来水的杀菌消毒剂 B.浓硫酸有吸水性,可用于干燥H2S 气体 C.Fe2O3是碱性氧化物,可用作颜料 D.SO2 具有还原性,可用作纸浆的漂白剂 9.下列有关Na2CO3 和NaHCO3 比较中,不正确的是()A.热稳定性:Na2CO3>NaHCO3 B.相同条件下在水中的溶解度:Na2CO3>NaHCO3 C.等质量的碳酸钠和碳酸氢钠与足量盐酸反应放出气体的量:Na2CO3<NaHCO3 D.相同条件下与等浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 10.蛟龙号载人潜水器外壳用特殊的钛合金材料制成,它可以在深海中承受700 个大气压的压力。已知金属钛的原子序数为22 ,化学性质与铝类似。下列说法不正确的是() A.在空气中将金属钛、铝混合后熔化可制得合金 B.钛合金硬度比单质钛大 C.TiO2 一定条件下可能会溶于强酸或强碱 D.钛合金的熔点低于单质钛 11.下列物质间的转化在给定条件下不能实现的是() A.取样,加入NaOH 溶液,若不产生使湿润的红色石蕊试纸变蓝的气体,则溶液不含NH4+ B.取样,先加入盐酸酸化,无现象,再加入BaCl2 溶液,若产生白色沉淀,则溶液中含SO42- C.取样,加入BaCl2 溶液,若产生白色沉淀,则溶液中含有CO32- D.取样,先加入适量盐酸酸化,再加入AgNO3 溶液,若产生白色沉淀,则溶液含Cl- 13.下列离子方程式,书写不正确的是()  14.如图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是 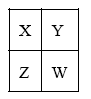 A.W 的氧化物对应的水化物的酸性比Z 的强 B.W 的原子序数可能是Y 的两倍 C.Y 元素的非金属性比Z 元素强 D.Z 的原子半径比X 的大 15.下列有关碱金属元素的说法中,正确的是() A.与水反应都能生成碱和氢气 B.碱金属的单质具有强还原性,可置换出硫酸铜溶液中的铜单质 C.与氧气反应都能生成过氧化物 D.随核电荷数的增加,碱金属元素单质的熔沸点都逐渐增大 16.下列除杂的方法(括号里为少量杂质)中,所用试剂或操作不正确的是() A.Cl2(HCl) :将气体通过装有饱和食盐水的洗气瓶 B.Fe2O3(Al2O3):加入NaOH 溶液,过滤C.CO2(HCl) :将气体通过装有饱和Na2CO3 溶液的洗气瓶 D.FeCl2 溶液(FeCl3):加入过量铁粉,过滤 17.下列有关“实验操作”、“现象”及“实验结论”都正确的是() 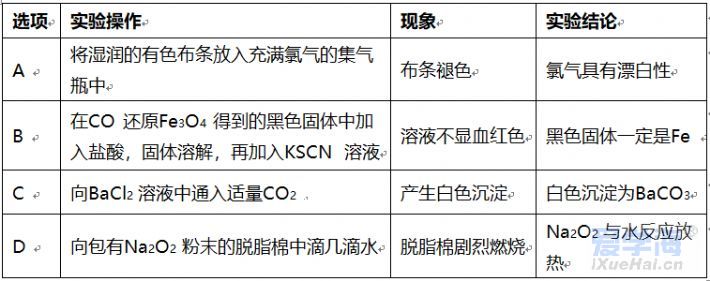 18.下列各图示中能较长时间看到Fe(OH)2 白色沉淀的是(已知:苯为难溶于水且密度比水小的液体) A.①②③ B.①②④ C.①③④ D.②③④ 19.如图是铜与浓硫酸反应的相关实验装置。下列有关判断不正确的是() A.装置A 中铜与浓硫酸反应氧化剂与还原剂的物质的量之比为1∶1 B.装置B 中盛装的是浓硫酸,作用是干燥SO2 C.装置C 为集气瓶,收集SO2 D.装置D 中品红溶液可检验反应生成的SO2,碱性棉球的作用是吸收过量的SO2 20.已知卤素互化物的性质与卤素单质类似,下列关于BrCl 的说法错误的是() A.BrCl 有强氧化性 B.BrCl 能与水发生氧化还原反应 C.BrCl 是共价化合物 D.BrCl 能与NaOH 溶液反应生成NaBrO 、NaCl 和H2O 21.已知K2R2O7 是一种强氧化剂,酸性条件下0.2molK2R2O7 恰好能将1.2molFeO 氧化,其产物为Rx+ ,则x 的值为 A.1 B.2 C.3 D.4 22.设NA 为阿伏伽德罗常数的值,下列说法正确的是()A.10gH218O 和2H2O 的混合物所含的质子数和中子数都是5NA B. 0.5mol•L-1 的KHSO4 溶液中含有的阳离子数目为NA C. 常温常压下,3.4gH2O2 中含共用电子对数为0.4NA D.2.3gNa 与含0.05molHCl 的盐酸反应,转移电子数为0.05NA 23.绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含NH+4 废水和工业废气(主要含N2 、CO2、SO2 、NO 、CO ,不考虑其他成分),设计了如图流程。已知:NO+NO2+2OH-=2NO2-+H2O,下列说法正确的是()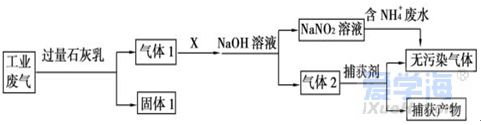 A.固体1 中主要含有CaCO3、CaSO4 B.X 可以是空气,且需过量 C.处理含NH+4废水时,发生的反应:NH+4 +5NO-2 +4H+=6NO↑+4H2O D.捕获剂所捕获的气体主要是CO 24.把一小块镁铝合金溶于100mL 盐酸中,然后向其中滴入1mol∙L-1NaOH 溶液,生成沉淀的质量和加入NaOH 溶液的体积如图所示,下列说法正确的是() A.反应至B 点时,所得沉淀的质量为1.07g B.盐酸的浓度为0.6mol∙L-1 C.合金中镁和铝的物质的量之比为1︰1 D.镁铝合金溶于盐酸时一共产生448mLH2 25.某溶液X 可能含有下列离子中的若干种:Na+、Mg2+ 、Fe3+ 、SO 2-4 、HCO 3-、Cl-,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取适量上述溶液X,进行了如下实验(所用试剂均足量),下列说法正确的是() A.白色沉淀A 一定含有BaSO4,可能含有BaSO3 B.无色气体A 可能是CO2 或SO2 C.溶液X 中一定存在Na+、Mg2+ 、SO4 、HCO3- D.溶液X 中一定不存在Fe3+ ,可能存在Cl- 非选择题部分 二、填空题(本大题共5题,共50分) 26.有以下物质:①CO2 ②Al2O3 ③胆矾④酒精⑤稀硫酸⑥NaHCO3 ⑦石墨(1) 属于电解质的是______(填序号,下同):属于非电解质的是:______ (2) ③的化学式:______ (3) ⑥在水中的电离方程式:______ 27.已知X、Y、Z、W、Q 为五种原子序数依次增大的短周期主族元素,常温下X 能与氢元素形成两种。常见的液态化合物,W 的原子序数是X 的两倍;Z 的离子半径在同周期简单离子中最小,Y 的最高价氧化物对应的水化物和Z 的最高价氧化物对应的水化物能发生反应。请回答: (1)Q 在元素周期表中的位置:___________ 。 (2)Y 的最高价氧化物的水化物中存在的化学键类型:___________ 。 (3)X 的简单氢化物比W 的简单氢化物熔沸点高的原因:___________ 。 (4)Z 与Q 两者的最高价氧化物对应的水化物反应的离子方程式:___________ 。 (5)Y 的氢化物可由单质化合而成,请用电子式表示该氢化物形成过程:___________ 。 28.为探究矿物X( 含三种常见元素)的组成和性质,某兴趣小组设计了如下实验:已知实验中所用试剂均足量,请回答如下问题: (1)X 所含元素的名称为:___________;固体I 的化学式为:___________。 (2) 检验溶液G 中的金属阳离子的实验方案:___________。 (3) 气体A 与溴水反应的离子方程式:___________。 (4)X 在高温下与氧气反应的化学方程式:___________。 29.Ⅰ.某科学探究小组设计以下装置依次完成氯气的制备、氯酸钠的制备、次氯酸钠的制备并探究氯水的性质。其中: ①为氯气发生装置,烧瓶中盛放MnO2 固体; ②的试管里盛有15mL30%NaOH 溶液,并置于热水浴中; ③的试管里盛有15mL8%NaOH 溶液,并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。请填写下列空白: (1) 如何检验装置①的气密性______ 。 (2) 如果实验室没有MnO2,下列物质可以用来代替MnO2 制Cl2 的是__ A.KMnO4 B.Fe2O3 C.浓硫酸 D.KClO3 (3) 制备氯酸钠的化学方程式为____ 。(4) 比较制取氯酸钠和次氯酸钠的条件,二者的差异是:_____ 。 (5) ④的试管里紫色石蕊试液现象及原因___________ 。 Ⅱ.(6) 次氯酸钠溶液可以杀灭新冠病毒,若将其与稀硫酸混合使用可增强消毒能力。现用18mol•L-1 浓硫酸来配制450mL0.2mol•L-1 的稀硫酸。 ①需用量筒量取浓硫酸的体积为___________mL 。 ②定容时的操作:当液面离容量瓶颈部的刻度线1~2cm 时,___________ ,盖好瓶塞,反复上下颠倒,摇匀。 ③若所配制的稀硫酸浓度偏高,则下列可能的原因分析中正确的是___________ 。 A.配制前,容量瓶用蒸馏水洗涤后再用硫酸润洗 B.量取浓硫酸时,读数时俯视液体的凹液面C.浓硫酸稀释后立即转移至容量瓶定容 D.颠倒摇匀后,液面低于刻度线,继续滴加蒸馏水 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版