【高中化学试卷】高一化学期末复习(二)
 2021-12-25
2021-12-25 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
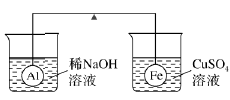
(时间:75分钟 满分:100分) 一、选择题(本题包括15小题,每小题只有一个选项符合题意,每小题3分,共45分) 1.(2019·广东学业考试)铁元素在地壳中含量丰富。下列有关说法不正确的是( ) A.不锈钢属于铁合金 B.用KSCN溶液可检验溶液中的Fe3+ C.铁制品腐蚀过程中铁被还原 D.浸在有机溶剂中不易生锈 2.(2019·山东学业考试)下列关于铁及其化合物的说法错误的是( ) A.实验室保存FeCl2溶液时常加入铁粉 B.可用KSCN溶液检验FeCl2溶液是否变质 C.若FeCl2溶液中混有FeCl3可通过滴加氯水除去 D.向FeCl2溶液中加入NaOH溶液,最终可观察到红褐色沉淀 3.(2019·广东学业考试)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是( ) A.该反应为置换反应 B.用KSCN溶液可检验废液中的Fe2+ C.可用置换法回收废液中的铜 D.Fe3+能溶解Cu说明Cu比Fe金属性强 4.(2019·广东学业考试)港珠澳大桥的建造使用了大量钢材。下列关于钢材的说法不正确的是( ) A.钢的主要成分是铁 B.表面喷涂油漆可防腐 C.不锈钢是最早使用的合金 D.不锈钢含碳量较生铁低 5.(2019·广东学业考试)新型镁合金被大量用于制造笔记本电脑外壳、竞赛自行车框架等。由此说明镁合金具有的优异性能包括( ) ①熔点低 ②硬度大 ③耐腐蚀 ④密度小 ⑤导电性强 A.①②④ B.②③④ C.②④⑤ D.③④⑤ 6.(2018·山东学业考试)某溶液中存在Na+、Mg2+、Fe2+、Fe3+四种阳离子,向其中加入过量氢氧化钠溶液并充分搅拌,再加入过量盐酸后,大量减少的离子是( ) A.Na+ B.Mg2+ C.Fe2+ D.Fe3+ 7.(2019·广东学业考试)铝材在人们的生活中使用广泛。有关铝及其化合物的说法正确的是( ) A.铝暴露在空气中易生锈 B.建筑用的铝材属于合金 C.Al溶于强碱溶液中产生O2 D.加过量NaOH溶液除去废水中含有的Al3+ 8.(2019·广东学业考试)既能与稀硫酸反应,又能与NaOH溶液反应的是( ) A.Mg B.Fe C.Al D.Cu 9.金属和合金是生活中常用的材料。下列说法正确的是( ) A.不锈钢是铁合金,只含金属元素 B.镧镍(La-Ni)合金能大量吸收H2,并与H2结合成金属氢化物,可作储氢材料 C.目前世界上使用量最大的合金是铝合金 D.常温下,铁粉可以和水发生置换反应得到氢气 10.下列关于金属的说法正确的是( ) A.铝箔在空气中受热可以熔化且会发生剧烈燃烧 B.Na在空气中燃烧,发出黄色火焰,生成白色固体 C.铁与水蒸气反应的产物是黑色的Fe2O3 D.铝制餐具不能用来盛装酸、碱、咸的食物 11.下列铁的化合物通过化合反应、置换反应、复分解反应均能得到的是( ) A.Fe3O4 B.Fe2(SO4)3 C.FeCl2 D.Fe(OH)3 12.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡,将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( ) A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 B.铝球表面有气泡产生,溶液澄清 C.反应后去掉两烧杯,杠杆仍平衡 D.铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边上升 13.下列关于铝的叙述不正确的是( ) A.铝是地壳中含量最多的金属元素 B.在化学反应中,铝容易失去电子,是氧化剂 C.在常温下,铝能与NaOH溶液反应 D.铝是一种比较活泼的金属 14.金属钛有“未来金属”之称,具有低密度、高硬度等性能,化学性质稳定。钛的化合价主要有+4价和+3价,其中+3价钛极易被氧化。下列有关说法正确的是( ) A.金属钛就是钛合金 B.Ti2O3化学性质稳定 C.FeTiO3(钛酸亚铁)中钛的化合价为+3价 D.钛及其合金可广泛应用于航空领域 15.只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,该试剂是( ) A.BaCl2溶液 B.CuCl2溶液 C.FeCl3溶液 D.FeCl2溶液 16.下列除去杂质的方法不正确的是( )
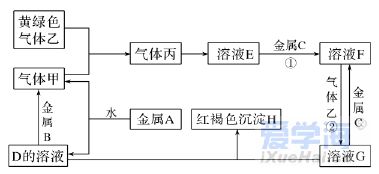
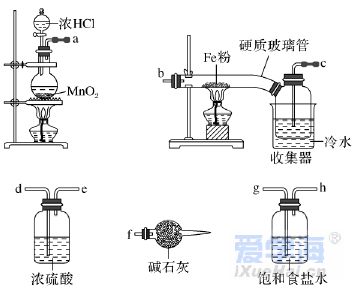
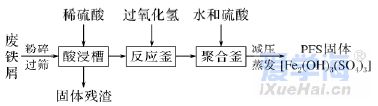
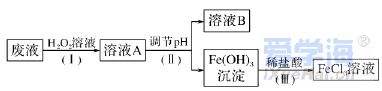
二、非选择题(本题包括4小题,共56分) 17.(14分)根据你学过的有关金属的知识,回答下列问题 (已知:铜、锌能与硝酸反应,而金不反应): (1)铜钱在我国历史上曾经是一种广泛流通的货币,如下图所示,铜常用于制造货币的原因可能是________(填字母)。 A.铜的熔点不是太高,易于冶炼,易于铸造成型 B.铜的性质不活泼,不易被腐蚀 C.我国较早地掌握了湿法冶炼铜的技术 D.自然界有大量的游离态的铜 (2)铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是________(填化学式,下同),常见的铁的氧化物还有________、________。 (3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为___________________________________________。 (4)一位收藏者有一枚表面是黑色,且有少量绿色锈状物的货币,这肯定是________币,黑色物质是________(填名称),形成这种物质的化学方程式为______________________________________, 绿色物质是________(填化学式),这枚金属币的真面目为________色。另外一枚是闪闪发光的黄色金属币,它肯定是________币,表面一直未被氧化的原因是_______________________________。 18.(14分)有三种金属单质A、B、C,其中A的焰色实验为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题: (1)写出下列物质的化学式:乙________、H________; (2)写出反应②的离子方程式:______________________________________; (3)写出金属A与水反应的离子方程式:___________________________________; (4)写出金属B与D的溶液反应的离子方程式:______________________________; (5)F与D溶液反应后的产物在空气中转化为H的化学方程式为_____________________________; 现象为___________________________________________________________。 19.(14分)已知三氯化铁的熔点为306 ℃,沸点为315 ℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验: (1)装置的连接顺序为________。 (2)饱和食盐水的作用是_______________________________________。 (3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: 固体混合物――→过量稀盐酸淡黄色溶液――→试剂X淡红色溶液 ――→过量H2O2溶液深红色溶液――→静置一段时间红色褪去K ①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为___________________________。 ②淡红色溶液中加入过量H2O2后溶液红色加深的原因是__________________________________。 (4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。 ①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。 ②另取同浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。 实验①说明________________________________________________________________________; 实验②的目的是____________________________________________________________________。 得出结论:溶液褪色的原因是________________________________________________________。 20.(14分) I. (2019·北京学业考试)聚合硫酸铁(PFS)是优质、高效的铁盐类无机高分子絮凝剂,主要用于净水。下图是以废铁屑(主要成分为Fe、Fe2O3)为原料制备PFS的一种工艺流程。 (1)酸浸槽中,Fe2O3与稀硫酸反应的离子方程式为________。 (2)反应釜中,加入H2O2的作用是________________________________。 (3)制备过程中,若需检验反应釜中含有的Fe3+,实验方案为:取少量反应釜中的溶液,向其中加入_______________________________________________________ (填试剂和现象),说明其中含有Fe3+。 II.(2019·福建学业考试)电子工业上常用氯化铁溶液做印刷电路铜板的腐蚀液,使用过的腐蚀废液中的金属离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。 (1)步骤(Ⅰ)中加入H2O2溶液的目的是将Fe2+________(填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显________(填“红色”或“蓝色”)。 (2)步骤(Ⅱ)中分离溶液B和沉淀的操作名称是________;该操作需用到的玻璃仪器有烧杯、普通漏斗和________。 (3)写出步骤(Ⅲ)中Fe(OH)3与稀盐酸反应的化学方程式:__________________________________。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
 移动版
移动版