【高中化学试卷】高一化学期末复习(四)
 2022-01-06
2022-01-06 
 iXueHai.cn
iXueHai.cn
 爱学海
字体 - 小
+ 大 纠错指正
爱学海
字体 - 小
+ 大 纠错指正
|
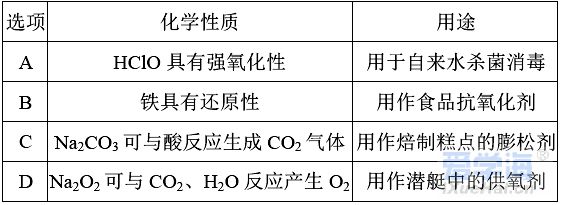
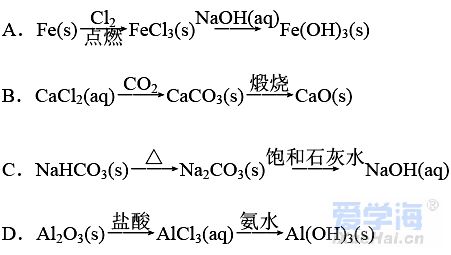
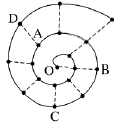
(时间:75分钟 满分:100分) 一、选择题(本题包括16小题,每小题只有一个选项符合题意,1~10题每小题2分,11~16题每小题4分,共44分) 1.化学与生活息息相关。下列说法错误的是( ) A.铝合金大量用于高铁建设 B.活性炭具有除异味和杀菌作用 C.生石灰可用作袋装食品干燥剂 D.光束通过云、雾会产生丁达尔效应 2.下列说法正确的是( ) A.钢、生铁、氧化铁均属于合金 B.盐酸、漂白粉、水银均为混合物 C.硝酸钠、氯化铵、纯碱均属于盐 D.一氧化碳、二氧化碳均属于酸性氧化物 3.含锂材料在社会生产与生活中应用广泛,如6Li和7Li用作核反应堆最佳热载体,7LiH和7LiD用作高温堆减速剂。下列说法正确的是( ) A.7LiH和7LiD互为同素异形体 B.7LiH和7LiD的化学性质不同 C.6Li和7Li核外电子排布方式相同 D.通过化学变化可以实现6Li和7Li间的相互转化 4.下列物质性质与用途对应关系错误的是( ) 5.对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的( ) A.SO2-3、OH-、Cl-、K+ B.K+、CO2-3、H+、Ba2+ C.Na+、NO-3、K+、Cl- D.Na+、NO-3、OH-、Cl- 6.设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.0.1 mol•L-1 K2SO4溶液中含有的K+数为0.2NA B.标准状况下,11.2 L H2O中含有的分子数为0.5NA C.32 g由O2和O3组成的混合气体中含有的原子数为2NA D.1 mol Cl2与足量的铁粉完全反应,转移的电子数为3NA 7.根据元素周期表及元素周期律,下列推断正确的是( ) A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 B.第ⅦA族元素的非金属性自上而下依次减弱 C.短周期元素形成离子后,最外层都达到8电子稳定结构 D.同主族元素的原子半径越大,其原子得电子能力越强 8.下列反应的离子方程式正确的是( ) A.Na与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ B.CuSO4溶液与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓ C.NaHCO3溶液与NaOH溶液混合:HCO-3+OH-=H2O+CO2-3 D.Ca(ClO)2溶液中通入少量CO2:Ca(ClO)2+CO2+H2O=CaCO3↓+2H++2ClO- 9.在给定条件下,下列选项所示的物质间转化不能实现的是( ) 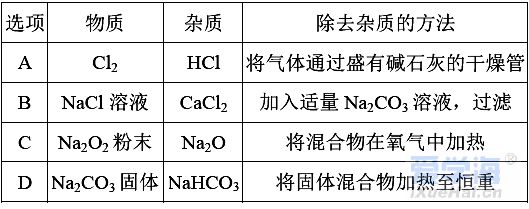 11.类比是研究物质性质的常用方法之一。下列类比正确的是( ) ①Cu与Cl2能化合生成CuCl2,则Fe与Cl2能化合生成FeCl3 ②Mg在空气中燃烧生成MgO,则Na在空气中燃烧生成Na2O ③NaHCO3可以治疗胃酸过多,则NaOH也可以治疗胃酸过多 ④Fe可以置换岀CuSO4溶液中的铜,则Al也可以置换出CuSO4溶液中的铜 A.②④ B.②③ C.①③ D.①④ 12.数字化实验是利用传感器和信息处理终端进行数据采集与分析的实验手段。如图是利用数字化实验测定光照氯水过程中得到的图像,该图像表示的意义是( ) 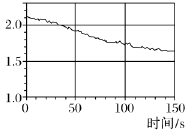 A.氯离子浓度随时间的变化 B.氧气体积分数随时间的变化 C.氯水的pH随时间的变化 D.氯水导电能力随时间的变化 13.某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O点代表氢元素。下列说法不正确的是( ) A.O、B的原子在反应中都容易失去最外层电子 B.虚线相连的元素处于同一族 C.B、C最高价氧化物对应的水化物可相互反应 D.最简单氢化物的热稳定性:A>D 14.《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为S+2KNO3+3C点燃K2S+3CO2↑+N2↑。下列说法错误的是( ) ①硝石的主要成分为硝酸盐 ②硫磺在反应中作还原剂 ③火药可用于制作烟花爆竹 ④每消耗1 mol KNO3,该反应转移5mol电子 A.①② B.②③ C.①③ D.②④ 15.运用元素周期律分析下面的推断,其中不正确的是( ) A.锂(Li)与水反应比钠与水反应剧烈 B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 D.HBrO4的酸性比HIO4的酸性强 16.根据下列实验操作和现象所得到的结论正确的是( ) 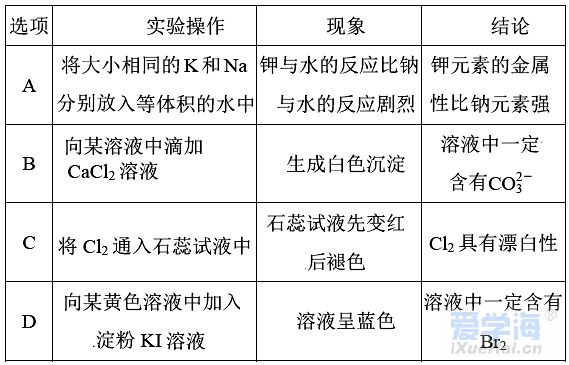 二、非选择题(本题包括4小题,共56分) 17.(14分)大气臭氧层可以保护地球生物免受紫外线的伤害,但低空臭氧的浓度过高时会对人体有害。 (1)在紫外线作用下,氧气可转化为臭氧:3O2=2O3。 ①该反应所属类型为________(填“氧化还原”或“非氧化还原”)反应。 ②若在上述反应中有60%的氧气转化为臭氧,所得混合气体的平均摩尔质量为________。(相对原子质量:O 16) ③某区域收集到O2和O3混合气体0.96 g,标准状况下体积为0.56 L,其中O2与O3的体积之比为________。 (2)复印机工作时易产生臭氧,会使湿润的KI淀粉试纸变蓝,其中臭氧部分转化为氧气。写出反应的方程式________________________________________。 (3)实验室中常用碘量法检测臭氧,其中以淀粉为指示剂,将臭氧通入碘化钾溶液中进行反应。现需450 mL 0.2 mol•L-1的KI溶液,用KI固体配制该溶液时,提供的仪器有:托盘天平、药匙、玻璃棒、烧杯、量筒、细口试剂瓶。(相对原子质量:K 39 I 127)①还缺少的仪器有(写名称)________;所需KI固体的质量为________g。 ②在配制过程中,下列操作会导致所配制溶液的浓度偏小的是________。 A.未洗涤烧杯和玻璃棒 B.使用前,容量瓶中有少量蒸馏水 C.定容时俯视凹液面 D.定容摇匀后静置,液面低于刻度线,继续加水至刻度线 18.(14分)利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题: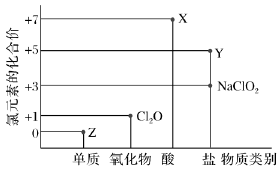 (1)X的电离方程式为__________________________________________________。 (2)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学式为________;Y在400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,生成的两种盐的化学式分别为________。 (3)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的________倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。 (4)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成 NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为____________________________。 19.(14分) Ⅰ.硫酸亚铁晶体(FeSO4•nH2O)是一种重要的食品和饲料添加剂,在实验室里可以通过下列流程用废铁屑制备。 (1)试剂a是________(填写名称),上述流程中涉及的物质主要有 ①Na2CO3(aq)、②H2O、③试剂a、④废铁屑、⑤FeSO4•nH2O,其中属于电解质的是________ (填化学式),酸溶时发生的主要反应的化学方程式为__________________________。 (2)上述流程中过滤操作所用的玻璃仪器有玻璃棒、________、烧杯。 (3)利用如图2装置对所得产品(FeSO4•nH2O)结晶水的含量进行测定。反应前称量C中的硬质玻璃管(80 g)、装入晶体后的硬质玻璃管(93 g)。反应后称得C中硬质玻璃管的质量为87.6 g。则产品硫酸亚铁晶体(FeSO4•nH2O)中n=________。 Ⅱ. (4)氯酸钠(NaClO3)是无机盐工业的重要产品之一。工业上制取氯酸钠采用在热的石灰乳中通入氯气,发生反应6Cl2+6Ca(OH)2≜5CaCl2+Ca(ClO3)2+6H2O,然后结晶除去氯化钙后,再加入适量的________(填试剂化学式),过滤后结品即可得到氯酸钠。Cl2与热的石灰乳反应中氧化剂和还原剂的质量之比为________。 Ⅲ.利用NaClO3制备NaClO2的工业流程如图所示: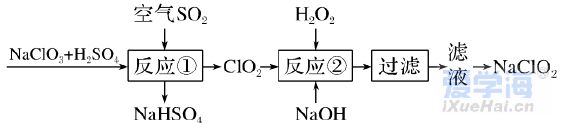 已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130 ℃分解。 ②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下稳定。 (5)反应①的氧化剂是________。 (6)反应①中鼓入空气的作用是________(填序号) a.将SO2氧化为SO3增强酸性 b.稀释ClO2防止爆炸 c.将NaClO3氧化为ClO2 (7)反应②的离子方程式为_______________________________________, H2O2表现________性。从NaClO2溶液获得产品的可行措施是________(填字母)。 a.蒸干灼烧 b.300℃热空气烘干 c.减压蒸发 20.(14分)氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素。回答下列问题: (1)锑在元素周期表中的位置为________。 (2)209 83Bi的中子数与质子数的差值为________。 (3)酸性:H3AsO4________H3PO4(填“>”或“<”),请从元素性质角度解释原因__________________________________________________________________。 (4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。 ①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是________元酸(填“一”、“二”或“三”)。 ②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4.利用H3PO2进行化学镀银时,氧化剂与还原剂的物质的量之比为________。 |
| 高三: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初三: 语文| 数学| 英语| 物理| 化学| 历史| 道德与法制 |
| 高二: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初二: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 高一: 语文| 数学| 英语| 物理| 化学| 地理| 生物| 历史| 思想政治| 信息技术| 初一: 语文| 数学| 英语| 物理| 地理| 生物| 历史| 道法 |
| 小学: 语文| 数学| 英语| 道德与法制| 科学| 试题: 小学| 初中| 中考| 高中| 高考| 作文: 小学| 初中| 高中| 满分| 技巧|素材|英汉词典 |
| 高校: 985/211| 各省市| 港澳台| 国外| 排名| 中考专辑| 高考专辑| 各省中学| 职业考试: 从业资格| 技术技能| 艺术等级| 公务员| 百年党史 |
| 课外: 教育动态| 教育法规| 老师榜| 家长帮| 学生派| 安全说| 古诗古文| 世界名著| 近代文学| 寓言故事| 格言名句| 阅读技巧| 在线许愿祝福 |
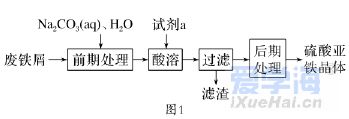
 移动版
移动版